Количество теплоты и удельная теплоемкость – в чем отличия
Содержание
Формула
Перед тем, как приступить к непосредственному расчёту параметра следует ознакомиться с формулой и её компонентами.
Формула для расчёта удельной теплоёмкости имеет следующий вид:
- с = Q/(m*∆T)
Знание величин и их символических обозначений, использующихся при расчёте, крайне важно. Однако необходимо не только знать их визуальный вид, но и чётко представлять значение каждого из них. Расчёт удельной теплоёмкости вещества представлен следующими компонентами:
ΔT – символ, означающий постепенное изменение температуры вещества. Символ «Δ» произносится как дельта.
ΔT можно рассчитать по формуле:
ΔT = t2–t1, где
- t1 – первичная температура;
- t2 – конечная температура после изменения.
m – масса вещества используемого при нагреве (гр).
Q – количество теплоты (Дж/J)
На основании Цр можно вывести и другие уравнения:
- Q = m*цp*ΔT – количество теплоты ;
- m = Q/цр*(t2 – t1) – массы вещества;
- t1 = t2–(Q/цp*m) – первичной температуры;
- t2 = t1+(Q/цp*m) – конечной температуры.
Что такое количество теплоты
Рассмотрим чашку, в которой находится обыкновенная вода комнатной температуры.
Вычислим внутреннюю энергию холодной воды в чашке, получим число, которое можно обозначить так:
(large U_{text{хол}} left( text{Дж} right) ) – внутренняя энергия холодной воды.
Нагреем воду в чашке. Молекулы нагретой воды будут двигаться быстрее. Значит, горячая вода обладает большим количеством внутренней энергии.
Теперь посчитаем внутреннюю энергию горячей воды в чашке. Полученное число обозначим, как
(large U_{text{горяч}} left( text{Дж} right) ) – внутренняя энергия горячей воды.
Найдем разницу внутренней энергии для горячей и холодной воды.
[large U_{text{горяч}} — U_{text{холод}}]
Примечание: Вместо слова «разница» математики скажут «разность».
Мы получим еще одно число. Обозначим его символом Q. Число Q называют количеством теплоты. Именно эту тепловую энергию вода получила во время нагревания.
[large boxed{ Q = U_{text{горяч}} — U_{text{холод}} }]
Примечание: Когда горячая вода остынет, она отдаст ровно столько тепловой энергии, сколько получила во время нагревания. Потому, что выполняется закон сохранения тепловой энергии.
(large Q left( text{Дж} right) ) – тепловая энергия, количество теплоты.
Теплота, как и любая энергия, измеряется в системе СИ в Джоулях, в честь английского физика Джеймса Джоуля.
Рис.1. Что такое количество теплоты
Примечание: Количество теплоты, так же, измеряют в Калориях.
Калория – это тепловая энергия, затраченная на нагревание 1 грамма воды на 1 градус Цельсия.
Джоуль и Калория связаны так:
[large boxed{ 1 text{ Калория} = 4{,}19 text{ Дж} }]
Удельная теплоемкость вещества вводится в тот момент, когда рассматривается ситуация с его нагреванием. Без него невозможно узнать, какое количество теплоты (или энергии) потребуется затратить на этот процесс. А также вычислить ее значение при охлаждении тела. Кстати, эти два количества теплоты равны друг другу по модулю. Но имеют разные знаки. Так, в первом случае она положительная, потому что энергию нужно затратить и она передается телу. Вторая ситуация с охлаждением дает отрицательное число, потому что тепло выделяется, и внутренняя энергия тела уменьшается.
Обозначается эта физическая величина латинской буквой c. Определяется она как некоторое количество теплоты, необходимое для нагревания одного килограмма вещества на один градус. В курсе школьной физики в качестве этого градуса выступает тот, что берется по шкале Цельсия.
Как ее сосчитать?
Если требуется узнать, чему равна удельная теплоемкость, формула выглядит так:
с = Q / (m * (t2 – t1)), где Q — количество теплоты, m — масса вещества, t2 – температура, которую тело приобрело в результате теплообмена, t1 — начальная температура вещества. Это формула № 1.
Исходя из этой формулы, единица измерения этой величины в международной системе единиц (СИ) оказывается Дж/(кг*ºС).
От чего зависит количество теплоты
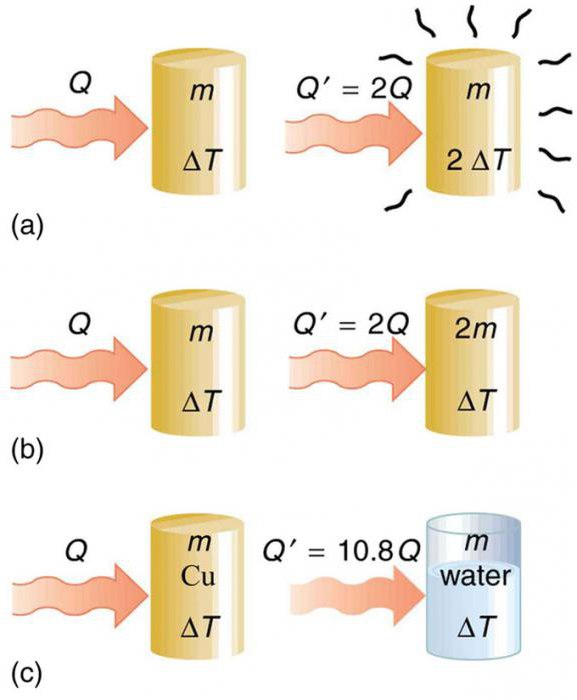
Количество теплоты, требуемое для нагревания тела, зависит от нескольких параметров.
Нальем в одну кастрюльку 1 кг воды, а в другую, точно такую же кастрюльку – 2 килограмма воды.
Пусть, начальная температура воды о обеих кастрюльках равна +20 градусам Цельсия.
Будем нагревать эти кастрюльки по очереди на газовой плите, не меняя интенсивность огня конфорки.
Предположим, нам нужно повысить на 50 градусов Цельсия температуру воды в каждой кастрюльке.
Примечание: После нагревания воды на 50 градусов, конечная температура воды в каждой кастрюльке будет равна 70 градусам.
Чтобы нагреть на 50 градусов 1 килограмм воды, потребуется время. Однако, чтобы нагреть на этой же конфорке 2 килограмма воды на 50 градусов, потребуется больше времени.
Значит, количество теплоты, полученное водой, зависит от массы вещества, которое мы хотим нагреть.
Математики запишут фразу «количество теплоты зависит от массы» так:
[large Q = f(m)]
Символом f обозначается зависимость.
(large m left( text{кг} right) ) – масса нагреваемого вещества.
Теперь возьмем две кастрюльки, и нальем в них по 1 кг воды. Начальная температура воды в кастрюльках одинаковая и равна +20 градусов Цельсия.
Одну кастрюльку будем нагревать дольше другой. Поэтому, температура воды будет выше в той кастрюльке, которую дольше нагревали.
Так как температура повысилась больше в кастрюльке, которую дольше нагревали, то физики скажут, что воде в этой кастрюльке передали большее количество теплоты.
Значит, количество теплоты зависит от разницы (т. е. разности) между начальной и конечной температурой.
[large Delta t = t_{text{конеч}} — t_{text{нач}}]
(large t_{text{конеч}} left( text{град} right) ) – температура после нагревания;
(large t_{text{нач}} left( text{град} right) ) – температура до нагревания;
(large Delta t left( text{град} right) ) – разность температуры;
Математики фразу «количество теплоты зависит от разности температур» запишут так:
[large Q = f(Delta t)]
Символ f обозначает, что Q зависит от разницы температур.
Теперь будем нагревать 1 килограмм воды и 1 килограмм подсолнечного масла.
Первоначальная температура каждого вещества +20 градусов Цельсия.
Измерим через 5 минут нагревания температуру воды и температуру масла.
Оказывается, за 5 минут масло нагреется до более высокой температуры. При этом и масло, и вода, получили одинаковое количество теплоты.
Значит, количество теплоты зависит от того, из какого вещества состоит тело.
Количество теплоты при различных физических процессах.
Большинство известных веществ могут при разных температуре и давлении находиться в твердом, жидком, газообразном или плазменном состояниях. Переход из одного агрегатного состояния в другое происходит при постоянной температуре (при условии, что не меняются давление и другие параметры окружающей среды) и сопровождается поглощением или выделением тепловой энергии. Не смотря на то, что во Вселенной 99% вещества находится в состоянии плазмы, мы в этой статье не будем рассматривать это агрегатное состояние.
Рассмотрим график, представленный на рисунке. На нем изображена зависимость температуры вещества Т от количества теплоты Q, подведенного к некой закрытой системе, содержащей определенную массу какого-то конкретного вещества.
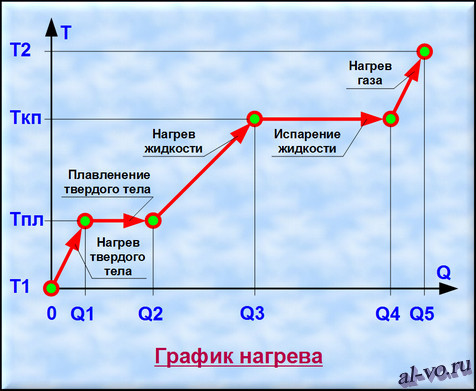
1. Твердое тело, имеющее температуру T1, нагреваем до температуры Tпл, затрачивая на этот процесс количество теплоты равное Q1.
2. Далее начинается процесс плавления, который происходит при постоянной температуре Тпл (температуре плавления). Для расплавления всей массы твердого тела необходимо затратить тепловой энергии в количестве Q2— Q1.
3. Далее жидкость, получившаяся в результате плавления твердого тела, нагреваем до температуры кипения (газообразования) Ткп, затрачивая на это количество теплоты равное Q3-Q2.
4. Теперь при неизменной температуре кипения Ткп жидкость кипит и испаряется, превращаясь в газ. Для перехода всей массы жидкости в газ необходимо затратить тепловую энергию в количестве Q4-Q3.
5. На последнем этапе происходит нагрев газа от температуры Ткп до некоторой температуры Т2. При этом затраты количества теплоты составят Q5-Q4. (Если нагреем газ до температуры ионизации, то газ превратится в плазму.)
Таким образом, нагревая исходное твердое тело от температуры Т1 до температуры Т2 мы затратили тепловую энергию в количестве Q5, переводя вещество через три агрегатных состояния.
Двигаясь в обратном направлении, мы отведем от вещества то же количество тепла Q5, пройдя этапы конденсации, кристаллизации и остывания от температуры Т2 до температуры Т1. Разумеется, мы рассматриваем замкнутую систему без потерь энергии во внешнюю среду.
Заметим, что возможен переход из твердого состояния в газообразное состояние, минуя жидкую фазу. Такой процесс именуется возгонкой, а обратный ему процесс – десублимацией.
Итак, уяснили, что процессы переходов между агрегатными состояниями вещества характеризуются потреблением энергии при неизменной температуре. При нагреве вещества, находящегося в одном неизменном агрегатном состоянии, повышается температура и также расходуется тепловая энергия.
Виды теплопередачи
- Теплопередача — это физический процесс передачи тепловой энергии от более нагретого тела к менее нагретому.
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем, что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии, которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой). Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики. Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Теплоемкость в разных процессах
Из определения ясно, что теплоемкость – это не только характеристика вещества, но еще и конкретного процесса, в котором телу передается тепло. Рассмотри, например, нагревание газа в условиях постоянного давления. Так происходит в сосуде с поршнем – при повышении температуры происходит расширение газа, из-за чего поршень выталкивается, а давление внутри остается прежним. В таком процессе для изменения температуры необходимо затратить больше тепла, чем для аналогичного нагревания того же газа в условиях постоянного объема.
Для жидкостей и твердых тел термическое расширение не столь значительно, поэтому для них значения теплоемкости в разных процессах примерно одинаково. Объясняется это различиями в молекулярной структуре.
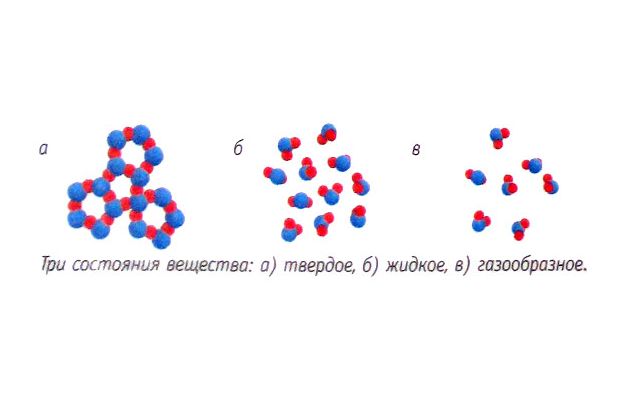
Рис. 1. Молекулярные структуру твердых тел, жидкостей и газов.
Процесс, в котором остается постоянным объем, называется изохорическим. Для него теплоемкость обозначается $C_V$ и рассчитывается по формуле:
$C_V = (frac {dQ}{dT})_V$

Рис. 2. Изохорический нагрев газа.
Но поскольку при постоянном объеме газ не совершает работы, то dQ = dU, где dU – внутренняя энергия. Тогда для одного моля газа запишем:
$C_V cdot dT = dU$
Или, учитывая выражение для внутренней энергии:
$C_V cdot dT = frac {i}{2} cdot R cdot dT$,
где i – степень свободы атомов газа, а R – универсальная газовая постоянная.
Отсюда следует, что при малых изменениях температуры для одного моля одноатомного газа удельная теплоемкость при постоянном объеме есть величина постоянная:
$C_V = frac {3}{2} cdot R$
Она соответственно будет увеличиваться при увеличении количества вещества.
Аналогично для теплоемкости одного моля вещества при постоянном давлении формула удельной теплоёмкости будет выглядеть так:
$ C_P = (frac {dQ}{dT})_P$
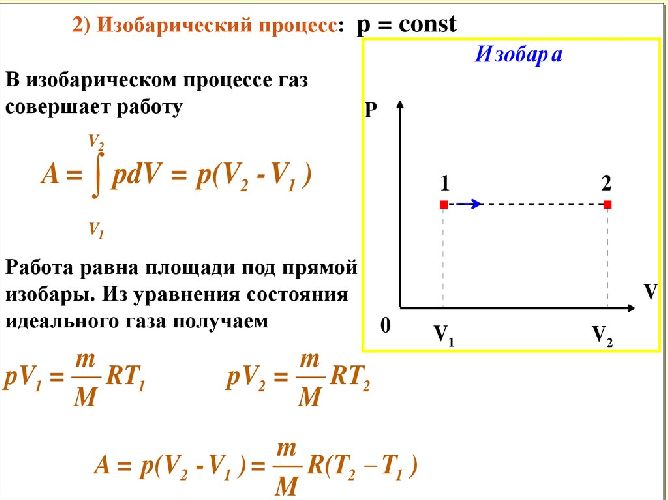
Рис. 3. Изобарический нагрев газа.
Но в данном случае газ совершает работу. Она вычисляется по формуле:
$dA = p cdot dV$ или $dA = R cdot dT$.
Внутренняя энергия же от объема не зависит, поэтому запишем:
$C_P = frac {5}{2} cdot R$
Получается, что при постоянном давлении теплоемкость также зависит только от температуры и количества вещества, но для малых изменений температуры остается постоянной.
Связь между теплоемкостями в изохорическом и изобарном процессах выражается формулой Майера:
$C_P = C_V + R$
Полезные советы
Всегда помните, что:
- процесс нагревания металла проходит быстрее, чем у воды, так как он обладает CP в 2,5 раза меньше;
- по возможности преобразуйте полученные результаты в более высокий порядок, если позволяют условия;
- в целях проверки результатов можно воспользоваться интернетом и посмотреть с для расчётного вещества;
- при равных экспериментальных условиях более значительные температурные изменения будут наблюдаться у материалов с низкой удельной теплоёмкостью.
[spoiler title=”Источники”]
- https://LivePosts.ru/articles/education-articles/fizika/formula-dlya-raschyota-udelnoj-teployomkosti-veshhestva
- https://formulki.ru/molekulyarka/kolichestvo-teploty-i-udelnaya-teploemkost
- https://www.syl.ru/article/222076/mod_udelnaya-teploemkost-dlya-chego-ona-nujna-i-v-chem-ee-smyisl
- http://al-vo.ru/teplotekhnika/raschet-teplovoy-moshchnosti.html
- https://skysmart.ru/articles/physics/udelnaya-teploemkost-veshestva
- https://www.webmath.ru/poleznoe/formules_21_24_kolichestvo_teploty.php
- https://obrazovaka.ru/fizika/udelnaya-teploemkost-formula.html
[/spoiler]























